Point de situation Fièvre Catarrhale Ovine (FCO) – 13 mai 2016
Laure Bournez (1), Corinne Sailleau (2), Claire Garros (3), Emmanuel Bréard (2), Renata Servan Almeida (3), Aurélie Pédarrieu (3), Geneviève Libeau (3), Stephan Zientara (2), Gina Zanella (4), Soline Hosteing (5), Pascal Hendrikx (1), Didier Calavas (6), Anne Bronner (7), Isabelle Tourette (8), Françoise Dion (9), Emmanuel Garin (10), Alexandra Troyano-Groux (7), Stéphanie Desvaux (7), Alexandre Fediaevsky (7), Lisa Cavalerie (7)
(1) Anses, Unité de coordination et d’appui à la surveillance, Direction des laboratoires, Maisons Alfort ; (2) Anses, UPEC, Laboratoire de santé animale de Maisons-Alfort, UMR ANSES, INRA, ENVA, Maisons-Alfort ; (3) Cirad, UMR CMAEE, Montpellier ; Inra, UMR CMAEE, Montpellier ; (4) Anses, Unité d’Epidémiologie, Laboratoire de santé animale de Maisons-Alfort ; (5) SNGTV, Paris ; (6) Anses, Unité d’épidémiologie, Laboratoire de Lyon ; (7) Direction générale de l’alimentation, bureau de la santé animale, Paris ; (8) GDS France, Paris ; (9) Race de France, Paris ; (10) Coop de France, Paris
Pour consulter cette note au format .pdf cliquez ICI
Bilan du nombre de foyers de fièvre catarrhale ovine (FCO) dus au virus BTV-8 détectés entre le 1er septembre 2015 et le 13 mai 2016
Depuis la confirmation du premier foyer de FCO le 11 septembre 2015, la surveillance de la maladie, dont l’objectif est la détection des élevages infectés et l’estimation de la distribution géographique du virus en France, repose sur plusieurs modalités :
- la surveillance évènementielle (suspicions cliniques)
- la réalisation d’enquêtes programmées (une première réalisée début septembre dans un rayon de 2 km autour du premier foyer détecté, une deuxième au plan national entre le 8 septembre et le 20 octobre 2015, et une troisième réalisée entre janvier et avril 2016)
- la réalisation d’analyses lors de mouvements d’animaux (de la zone réglementée vers la zone indemne, pour l’exportation ou lors de rassemblements d’animaux).
Une surveillance entomologique est également mise en place depuis le 16 novembre 2015 afin de déterminer les périodes d’inactivité vectorielle en fonction des zones géographiques (voir l’article /node/35846 ).
Un élevage infecté (ou foyer) est un élevage dans lequel au moins un animal a présenté un résultat positif en PCR pour le virus de la FCO. La durée de détection du génome viral du virus BTV-8 par RT-PCR pouvant être longue, jusqu’à six mois (Di Gialleonardo et al. 2011, Zanella et al. 2013), la détection de nouveaux foyers peut refléter une circulation virale ayant eu lieu jusqu’à six mois avant la date d’analyse. Il n’est donc pas étonnant de détecter des foyers même pendant la période d’inactivité vectorielle.
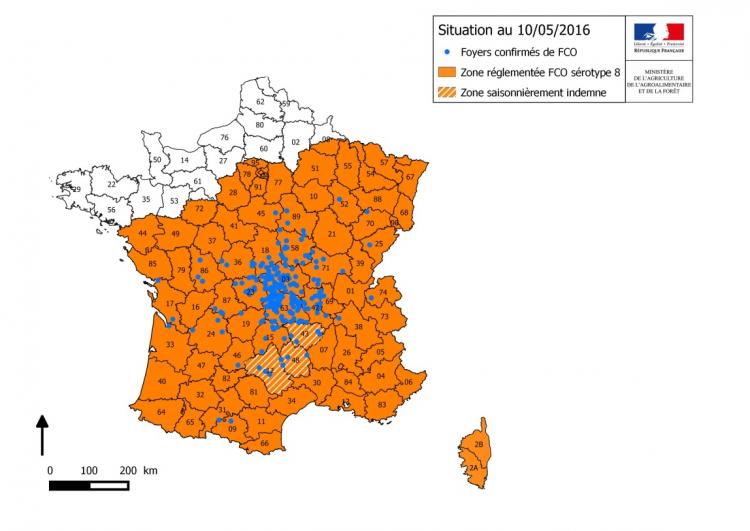
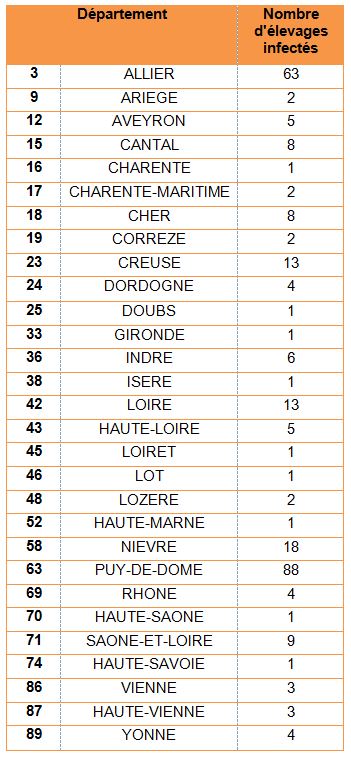
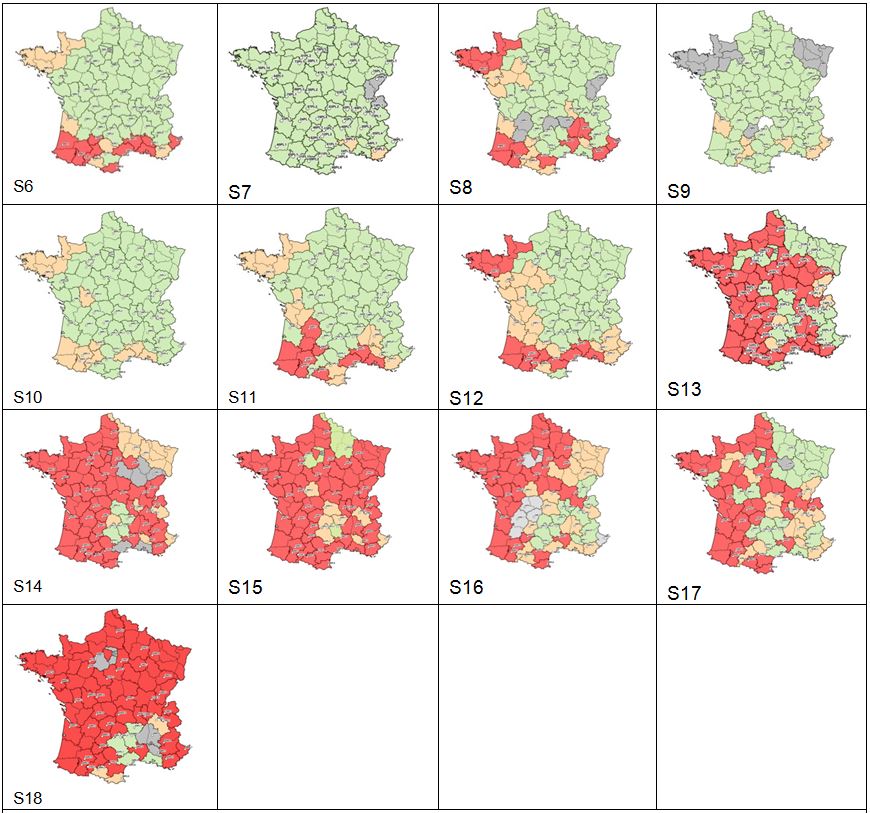
Au 13 mai, ce sont au total 271 élevages qui ont été déclarés infectés par le virus FCO de sérotype 8 (Figure 1). Les départements les plus touchés sont le Puy-de-Dôme et l’Allier avec 151 élevages infectés pour ces deux départements (Tableau 1). Parmi l’ensemble des foyers :
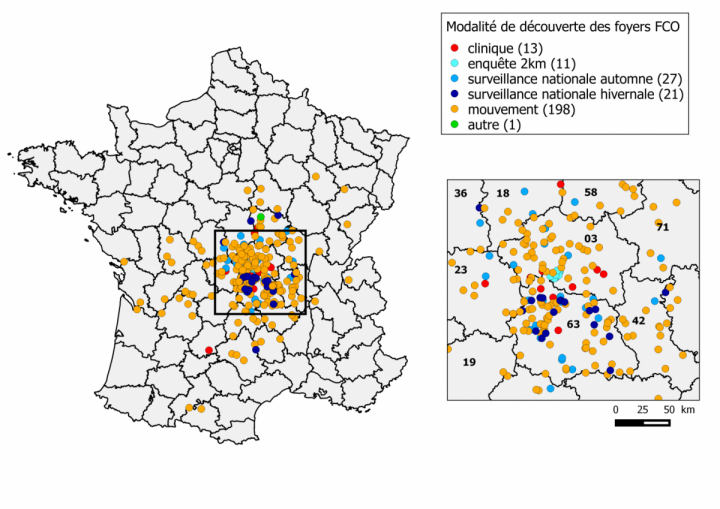
- 11 ont été détectés lors de la première enquête dans les 2 km autour du premier foyer de l’Allier
- 27 par la surveillance programmée réalisée en septembre-octobre 2015
- 21 par la surveillance programmée réalisée de janvier à avril 2016
- 13 par la surveillance évènementielle suite à des suspicions cliniques
- 198 lors de tests réalisés pour la sortie des animaux de la zone réglementée
- un foyer par découverte fortuite (investigation lors d’une série d’avortements) (Figure 2).
Ces foyers représentent 255 élevages de bovins, 4 élevages d’ovins, 1 élevage de caprins, 10 élevages mixtes bovin/ovin ou bovin/ovin/caprin et 1 élevage ovin/caprin.
Figure 1 : Zones réglementées au 10/05/2016 et foyers de FCO à sérotype 8 détectés au 10 mai 2016
Figure 2: Répartition des foyers par modalité de découverte (point au 13 mai 2016) (a) lors de l’enquête réalisée dans les élevages situés à moins de 2 km du premier foyer (« enquête 2 km »), (b) lors de l’enquête programmée réalisée du 8 septembre au 20 octobre (« enquête nationale automnale »), (c) lors de l’enquête programmée réalisée entre janvier et avril « enquête nationale hivernale », (d) lors de suspicions cliniques, (e) lors d’analyses réalisées lors de mouvements d’animaux (entre les zones réglementée et non réglementée, pour l’exportation ou lors de rassemblements d’animaux (« mouvement »).
Tableau 1 : Répartition du nombre de foyers de FCO à sérotype 8 par département au 13 mai 2016
Résultats de la surveillance entomologique
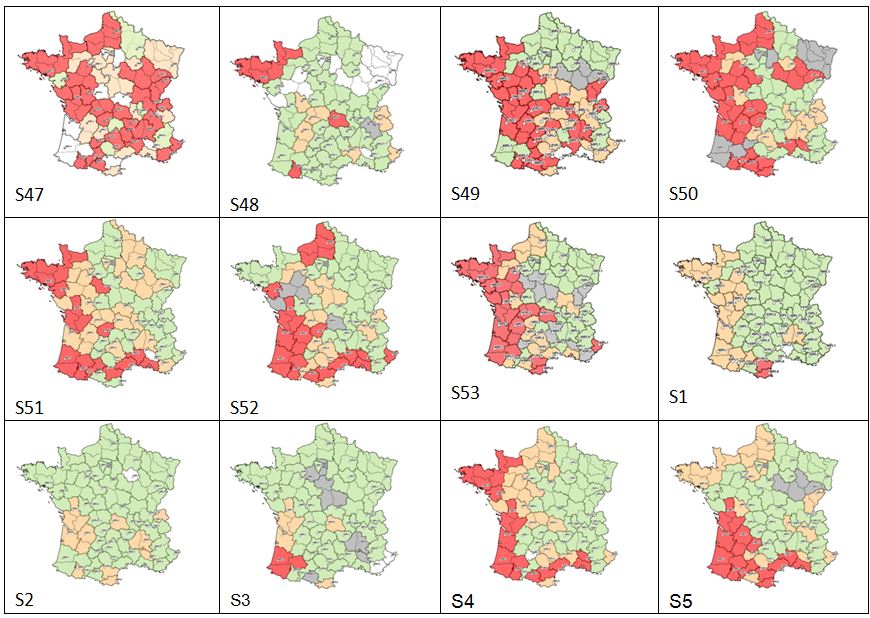
La surveillance des populations de Culicoides a débuté le 16 novembre 2015, et s’est poursuivie jusqu’à mai 2016 avec une fréquence de piégeage hebdomadaire. Un total de 50 pièges couvrant le territoire continental a été sélectionné définissant 50 zones géographiques (voir l’article /node/35846 ) (Figure 3). Les prélèvements reçus sont identifiés selon trois classes : « absence de Culicoides », « présence de 1 à 4 femelles pares – ayant pris au moins un repas de sang- » et « présence de plus de 5 femelles pares ». L’absence d’activité des populations de Culicoides est validée lorsque le prélèvement d’une nuit de capture contient moins de cinq femelles pares (seuil réglementaire) pour deux semaines consécutives (i.e. deux nuits de piégeage réalisée à une semaine d’intervalle). Il y a activité des populations lorsque le seuil réglementaire (présence de plus de 5 femelles pares) est atteint pour une nuit de capture.
L’hiver 2015-2016 a été un hiver particulièrement humide et doux, bien au-dessus des moyennes et normales saisonnières, et ce sur l’ensemble du territoire continental. Ces conditions météorologiques favorables à une activité des populations de Culicoides expliquent l’activité marquée au-dessus du seuil réglementaire jusqu’à fin décembre 2015 (semaine 53) pour une grande moitié Ouest de la France. La baisse des températures en début d'année 2016 a vraisemblablement réduit l'activité des populations (semaine 1 et 2 avec la grande majorité des zones en inactivité réglementaire) mais sans induire de mortalité puisque l'activité est à nouveau très marquée en semaine 4 sur la façade atlantique. Pour une grande partie de la moitié Est de la France, la période d’inactivité vectorielle s’est située entre début décembre 2015 (semaine 51) et début avril 2016 (semaine 13).
Figure 3: Résultat de la surveillance hebdomadaire de l’activité des populations de Culicoïdes (vecteurs de la FCO) sur le territoire continental. Rouge : plus de 5 femelles pares par nuit de capture, orange : entre 1-4 femelles pares par nuit de capture, vert : absence de Culicoides, blanc : données non exploitables, gris : absence de piégeage
Résultats de la surveillance évènementielle
La surveillance évènementielle repose sur l’analyse par RT-PCR de tout animal présentant des signes cliniques évocateurs de FCO (cf. l’instruction technique DGAL/SDSPA/2015-785). La liste des signes cliniques décrit est assez large afin de prendre en compte les différentes formes cliniques de la FCO, ce qui permet d’optimiser la sensibilité du dispositif.
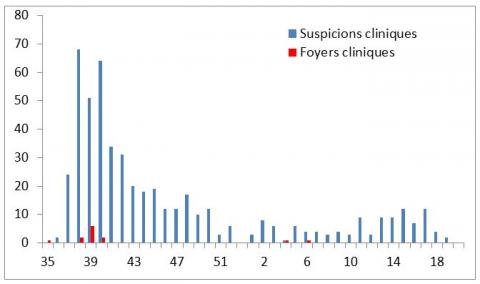
Entre septembre 2015 et mai 2016, il y a eu au moins 570 élevages dans lesquels au moins un animal a été suspect clinique (Figure 4). Le nombre de cas cliniques suspects de FCO a été le plus élevé en septembre et octobre 2015 (avec un pic de 70 élevages dans lesquels au moins un animal a été suspect clinique par mois) et a significativement diminué à partir de novembre 2015. Il n’est pas surprenant d’observer une telle diminution étant donné qu’une partie de la France est entrée en période d’inactivité vectorielle à partir de novembre (puis entre début et fin décembre 2015 pour les autres départements). On observe une bonne répartition des cas suspects sur l’ensemble du territoire continental puisque 85 % des départements (sans compter les départements de l’Ile de France) ont rapporté et analysé au moins un animal présentant des signes cliniques évocateurs de FCO entre septembre et décembre 2015. Le nombre de suspicions cliniques analysées a été plus important (entre 10 et 20 élevages analysés) dans deux zones géographiques : dans les départements du bassin allaitant du centre de la France (Allier, Nièvre, Cher, Puy-de-Dôme, Loire, Haute-Loire) situés au cœur de la zone infectée et dans les départements de la Normandie et du nord de la région Pays de la Loire, situés en zone indemne de FCO.
Peu de foyers et d’animaux (9 bovins et 4 ovins) ont été détectés par suspicion clinique ; ceux-ci sont situés dans les départements de l’Allier, du Puy de Dôme, du Cher, de la Creuse, de la Nièvre et du Lot. Hormis deux foyers, ils ont été détectés entre le 26 août et le 1er octobre 2015 (date à laquelle les prélèvements ont été réalisés). Les signes cliniques observés sont ceux décrits habituellement pour la FCO (Encadré 1). Les deux autres foyers ont été détectés en janvier 2016 suite à des avortements chez des bovins ou des ovins avec un résultat PCR positif chez l’avorton. Il n’est pas surprenant de détecter des foyers suite à des suspicions cliniques en période d’inactivité vectorielle si cela fait suite à des avortements.
Figure 4 : Nombre d’élevages suspects cliniques de FCO par semaine, pour lesquels une analyse a été réalisée entre début septembre (semaine 36) et début mai (semaine 18).
| Encadré 1 : signes cliniques décrits chez les bovins et ovins infectés entre août 2015 et février 2016 Les signes cliniques ont été renseignés pour 11 des 13 foyers détectés suite à une suspicion clinique. Chez les bovins (7 animaux de 7 élevages renseignés), les signes observés sont :
|
Bien que le nombre de suspicions cliniques analysées pour la FCO ait augmenté fortement après la découverte du premier foyer et en particulier dans les zones infectées, très peu de foyers ont été détectés suite à ces suspicions (7 % des foyers en 2015). De septembre à décembre 2015, le taux de confirmation suite à une suspicion clinique a été faible à l’échelle de la France (3 %) et de 23 % (10 foyers sur 44 suspicions cliniques) dans les quatre départements situés au cœur de la zone infectée (Puy-de-Dôme, Allier, Creuse et Loire). Ces chiffres sont également confortés par les observations remontées du terrain sur l’absence de signes cliniques apparents dans les foyers de FCO détectés par la surveillance programmée. En 2007 et 2008, les foyers étaient principalement détectés suite à des suspicions cliniques. Cependant, des études a posteriori ont montré que seule une faible proportion des élevages et des animaux infectés était en réalité cliniquement atteinte. Ainsi, moins de 8 % des élevages infectés en Belgique durant l’hiver 2006-2007 (Méroz et al. 2008) et dans quatre départements français sur cinq étudiés durant l’hiver 2007-2008 (Durand et al. 2010) ont présenté des signes cliniques. De même, en Allemagne, il a été estimé un taux de morbidité chez les bovins de 2 % et chez les ovins de 6 % en 2006 et 2007 (Conraths et al., 2009). En France, en 2015, le nombre total d’élevages et d’animaux infectés en 2015 n’est pas connu précisément. Il est donc difficile de déterminer si cette nouvelle épizootie entraîne moins de signes cliniques chez les bovins en comparaison de celle de 2007-2008 étant donné les sous-estimations éventuelles du nombre de cas cliniques et du nombre d’animaux infectés.
Analyses PCR réalisées suite aux échanges
Un total de 78 209 ruminants ont été analysés par PCR vis-à-vis de la FCO pour des analyses « mouvements » avec les résultats enregistrés dans Sigal (et transmis au CSD-ESA) entre le 1er septembre et le 29 avril 2016 : 77 948 (99,7%) sont des bovins, 207 (0,3%) des ovins, et 54 des caprins. Il est très probable que ce chiffre sous-estime le nombre d’analyses « mouvements » réalisées car toutes les données n’ont pas été enregistrées systématiquement dans Sigal (problèmes de paramétrages des LIMS de certains laboratoires).
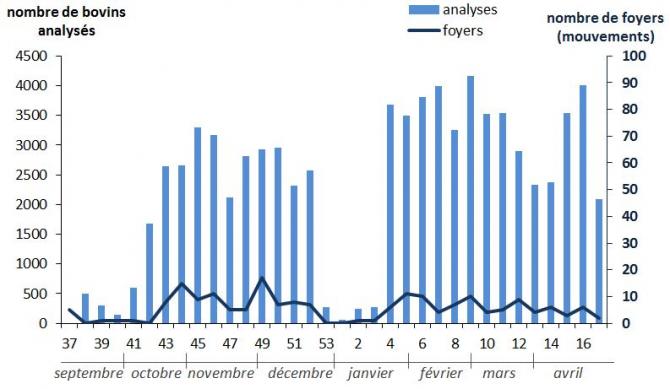
Ces analyses ont commencé à être réalisées à partir d’octobre 2015 (semaine 42, date de mise en place des protocoles permettant la sortie des animaux de leur zone sous certaines conditions) et leur nombre a varié entre 1500 et 4000 par semaine entre octobre 2015 et fin avril 2016 sauf entre le 28 décembre 2015 et le 24 janvier 2016 (Figure 5). La diminution du nombre d’analyses enregistrées dans Sigal pendant ces trois semaines en janvier peut s’expliquer en partie par l’arrêt du protocole permettant l’envoi de veaux de moins de 70 jours vers l’Espagne. Ceci peut également expliquer le fait qu’aucun foyer de FCO n’ait été détecté à cette période. Le nombre de ces analyses a ensuite augmenté en février et mars 2016 (augmentation du nombre d’animaux sortant de la ZR, augmentation de la taille de la ZR). A noter qu’en septembre, les foyers « mouvements » ont été détectés suite à des analyses réalisées sur des animaux suite à des rassemblements d'animaux
Figure 5 : Nombre d’analyses PCR FCO réalisées lors de mouvements d’animaux (sortie des animaux hors de la zone réglementée) et enregistrées dans Sigal par semaine et nombre de foyers détectés suite ces analyses
Nombre de foyers détectés au cours du temps
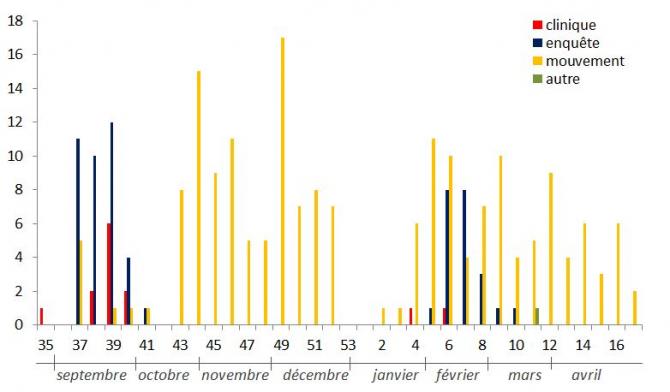
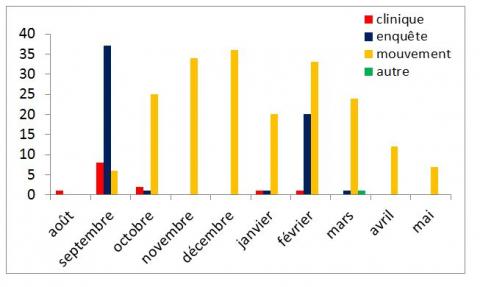
En moyenne sept foyers (entre 0 et 19) ont été détectés chaque semaine entre septembre 2015 et mai 2016 (Figure 6). Le nombre de foyers détectés a été nul à faible pendant deux périodes : début octobre 2015 (semaine 41 et 42) et fin décembre 2015-début janvier 2016 (de la semaine 53 à la semaine 3), ce qui peut s’expliquer par l’absence de prélèvements réalisés dans le cadre de la surveillance programmée et/ou de départ d’animaux testés aux échanges. Entre les deux périodes de réalisation des enquêtes nationales, ces foyers ont été principalement détectés suite aux analyses faites sur les animaux pour sortie de la zone réglementée (73% des foyers).
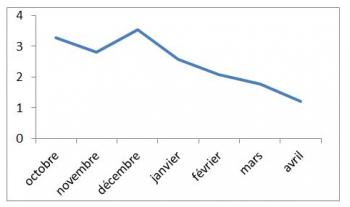
Etant donné la longue durée de détection du génome viral par PCR (jusqu’à 4 à 6 mois), il n’est pas étonnant de détecter des foyers pendant la période d’inactivité vectorielle (qui a débuté selon les départements entre début décembre 2015 et début janvier 2016), ces animaux ayant pu être infectés dans les mois précédant la date du prélèvement. Le nombre de foyers détectés semble diminuer depuis mars 2016 avec en particulier 12 foyers détectés en avril, alors que 25 à 36 foyers ont été détectés les mois précédents (sans compter le mois de janvier) (Figure 6 et 7). Cette diminution du nombre de foyers peut s’expliquer par le fait qu’on arrive en fin de période de détection d’infections ayant pu avoir lieu entre septembre et décembre (fin de période d’activité vectorielle) et que le nombre d’analyses « mouvements » a diminué à partir d’avril. Deux éléments confortent la première partie de cette hypothèse : la diminution depuis janvier du ratio du nombre mensuel de foyers « mouvements » sur le nombre d’analyses « mouvements » mensuelles enregistrées dans Sigal (Figure 8) ; et l’augmentation de la valeur du Ct (cycle threshold ou cycle seuil représentant le nombre minimal de cycles pour détecter une amplification génomique) de la PCR entre décembre et avril, indiquant des charges virales faibles.
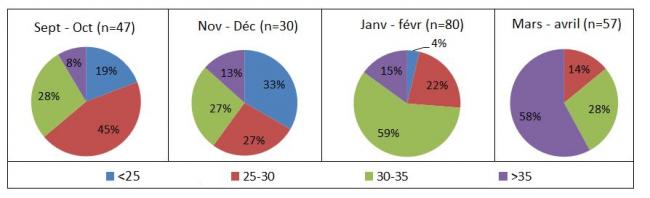
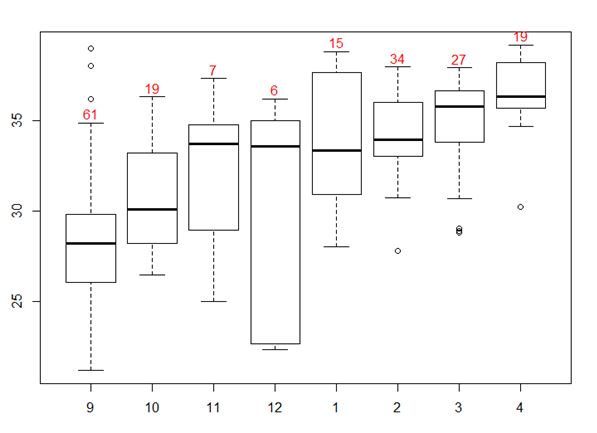
La valeur du Ct de la PCR donne une indication de la charge virale des animaux infectés, elle est inversement proportionnelle à la charge virale. Cette donnée est disponible pour 306 animaux infectés dont 188 ont été analysés au LNR. Etant donné les techniques de PCR différentes entre les LDA, cette valeur n’est pas comparable d’un laboratoire à l’autre (variation de Ct de 2 à 3 points entre les techniques) mais elle peut quand même donner une idée de grandeur. Entre septembre et décembre, une grande variation de la valeur de Ct a été observée avec des valeurs comprises entre 20 et 38 (Figure 9 et 10). A partir de janvier, les valeurs de Ct étaient plus élevées par rapport aux valeurs observées sur la période de septembre à décembre avec 92% des 188 analyses PCR positives du LNR avec des valeurs de Ct supérieures à 30 et 52% supérieure à 35, indiquant des charges virales faibles. En avril, les Ct étaient particulièrement élevés puisque 81% des analyses positives au LNR et au LDA avaient un Ct supérieur à 35.
Figure 6 : Nombre de foyers détectés par semaine et par modalité de surveillance entre début septembre (semaine 35) et début mai (semaine 17)
Figure 7 : Nombre de foyers détectés par mois et par modalité de surveillance (point au 13 mai 2016)
Figure 8 : ratio du nombre « d’analyses mouvements » sur le nombre de foyers détectés suite aux « analyses mouvements » par mois entre octobre 2015 et avril 2016
Figure 9 : Distribution de la valeur du Ct de la PCR FCO (visant tout sérotype) des animaux infectés (n=306 animaux pour lesquels la donnée était disponible et analysés dans les LDA ou le LNR) par mois
Figure 10 : Boxplot par mois des valeurs du Ct des 188 animaux infectés et analysés par le LNR (Anses, Maisons-Alfort). En rouge est noté le nombre par mois d’animaux infectés et analysés au LNR.
Pour plus d’informations :
Bournez L., Sailleau C., Bréard E., Zientara S., Zanella G., Troyano-Groux A., Hendrikx P., Fediaevsky A., Cavalerie L. (2016) Ré-émergence de la Fièvre catarrhale ovine BTV-8 en France: bilan de la situation épidémiologique entre septembre et décembre 2015. Bulletin épidémiologique Santé animale, alimentation.
http://bulletinepidemiologique.mag.anses.fr/sites/default/files/Reemerge...
Références
Di Gialleonardo, L., Migliaccio, P., Teodori, L., Savini, G., 2011. The length of BTV-8 viraemia in cattle according to infection doses and diagnostic techniques. Res. Vet. Sci. 91, 316–320.
Conraths, F.J., Gethmann, J.M., Staubach, C., Mettenleiter, T.C., Beer, M., Hoffmann, B., 2009. Epidemiology of bluetongue virus serotype 8, Germany. Emerg. Infect. Dis. 15, 433.
Méroc, E., Faes, C., Herr, C., Staubach, C., Verheyden, B., Vanbinst, T., Vandenbussche, F., Hooyberghs, J., Aerts, M., De Clercq, K., 2008. Establishing the spread of bluetongue virus at the end of the 2006 epidemic in Belgium. Vet. Microbiol. 131, 133–144.
Zanella, G., Martinelle, L., Guyot, H., Mauroy, A., De Clercq, K., Saegerman, C., 2013. Clinical Pattern Characterization of Cattle Naturally Infected by BTV‐8. Transbound. Emerg. Dis. 60, 231–237.